EMH Schweizerischer Ärzteverlag AG
Farnsburgerstrasse 8
CH-4132 Muttenz
+41 (0)61 467 85 44
support@swisshealthweb.ch
www.swisshealthweb.ch
Publiziert am 03.05.2023
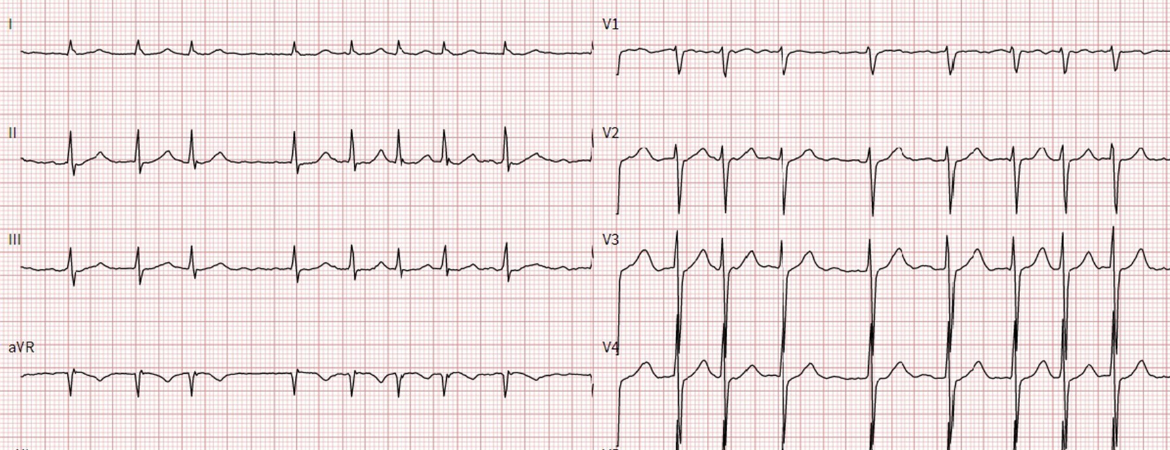
| Tabelle 1: Klassifikation des Vorhofflimmerns (VHF) (modifiziert nach [5]) | |
| Erstmals diagnostiziertes VHF | Erste Dokumentation (unabhängig von vermuteter Vorliegensdauer/Symptomen) |
| Paroxysmales VHF | Beendigung spontan oder durch Intervention innerhalb von 7 Tagen |
| Persistierendes VHF | Beendigung nach ≥7 Tagen, spontan oder durch Intervention |
| Langanhaltend persistierendes VHF | Anhaltend über >12 Monate, aber Rhythmuskontrolle ist Ziel |
| Permanentes VHF | Anhaltend ohne Bestrebungen einer Rhythmuskontrolle |
| Tabelle 2: Erste diagnostische Schritte und deren Prozedere nach Sicherung der Diagnose Vorhofflimmern mittels Elektrokardiogramms | ||
| Anamnese | Diagnostiktool | Prozedere |
| Symptomatik | EHRA Score [1] | Ambulante oder stationäre Behandlung und weitere Abklärung in Abhängigkeit von den Symptomen und den Komorbiditäten |
| 1 = keine Beschwerden | Ambulante Behandlung | |
| 2a = Alltag durch VHF-bezogene Beschwerden nicht beeinträchtigt | Ambulante Behandlung | |
| 2b = Alltag durch VHF-bezogene Symptome nicht beeinträchtigt, aber beunruhigte/r Patient/in | Ambulante Behandlung | |
| 3 = Alltag durch VHF-bezogene Symptome beeinträchtigt | Hospitalisation erwägen | |
| 4 = Alltag aufgrund behindernder Symptome nicht mehr möglich | Hospitalisation | |
| COPD | Kardinalsymptome erfragen (Dyspnoe, Husten, Auswurf) | Spirometrie Röntgen-Thorax in 2 Ebenen Pneumologische Standortbestimmung |
| Asthma bronchiale | Kardinalsymptome erfragen (Husten, «Wheezing» nach Anstrengung oder Allergenexposition) | Spirometrie Peak Flow Pneumologische Standortbestimmung |
| OSAS | Kardinalsymptome erfragen, Epworth Schläfrigkeits-Skala | Polysomnographie CPAP-Therapie |
| Nikotin | Ausmass erfragen | Nikotinstopp oder mindestens -reduktion empfehlen |
| Körperliche Aktivität | Ausmass und Intensität erfragen | Moderate körperliche Aktivität empfehlen (Beginn 20 min 3×/Woche, Steigerung auf 150 min/Woche) |
| Alkohol | Quantifizieren (Trigger bei >14 Standardgläsern/Woche) | Reduktion auf <7 Standardgläser/Woche empfehlen |
| Untersuchung | ||
| Blutdruckmessung | Praxismessung und ggf. regelmässige Heimmessungen | Antihypertensive Therapie gemäss ESC-Guideline «Arterielle Hypertonie» [8] |
| Temperaturmessung | Fieber | Ggf. Infektfokussuche |
| Volumenstatus | Auskultation pulmonal,Beurteilung Halsvenen, Beinödeme | Behandlung der Herzinsuffizienz |
| Adipositas | BMI ≥30 kg/m2 | Gewichtsreduktion empfehlen, optimal ≥10% des Körpergewichts und BMI <27 kg/m2 |
| Labor | ||
| Blutbild | Anämie behandeln | |
| Entzündungsparameter | Suche Infektfokus und Behandlung | |
| HbA1c | Behandlung Diabetes | |
| TSH | Behandlung Schilddrüsenfunktionsstörung (Hyper- und Hypothyreose) | |
| Lipidprofil | Behandlung gemäss ESC-Guideline «Dyslipidämie» [19] | |
| Nierenfunktion | Anpassung medikamentöse Therapie | |
| Bildgebung | ||
| TTE | Begleitende Herzkrankheit | Entsprechend zugrunde liegender Erkrankung: medikamentöse Therapie ggf. Device/Intervention ggf. weiterführende Diagnostik |
| BMI: Body Mass Index; CPAP: «continuous positive airway pressure»; CRP: C-reaktives Protein; EHRA: «European Heart Rhythm Association»; ESC: «European Society of Cardiology»; HbA1c: Hämoglobin A1c; OSAS: obstruktives Schlafapnoesyndrom; TTE: transthorakale Echokardiographie. | ||
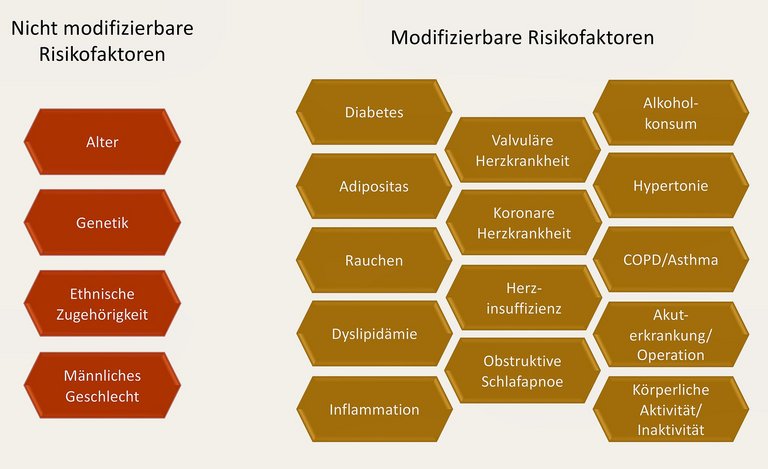
| Tabelle 3: Die vier Säulen der Behandlung von Patientinnen und Patienten mit Vorhofflimmern (Details vgl. [1, 24]) | |||
| Lifestyle- & Risikofaktoren Management | Thromboembolieprophylaxe | Frequenzkontrolle | Rhythmuskontrolle |
| Richtlinienbasierte Therapie der (kardiovaskulären) Grundkrankheiten Arterielle Hypertonie Diabetes mellitus Adipositas OSAS COPD Asthma bronchiale Alkoholkonsum Körperliche Aktivität Nikotinabusus | Antikoagulation in Abhängigkeit vom Risiko NOAC Vitamin-K-Antagonisten | Betablocker Verapamil, Diltiazem Digoxin Amiodaron | Klasse-I-Antiarrhythmika (Flecainid, Propafenon) Klasse-III-Antiarrhythmika (Sotalol, Dronedaron, Amiodaron) Betablocker Verapamil |
| Vorhofsohrverschluss | Pace & ablate | Vorhofflimmer-Ablation | |
| COPD: chronisch obstruktive Lungenerkrankung; NOAC: «novel oral anticoagulants» oder «non-vitamin K antagonist oral anticoagulants»; OSAS: obstruktives Schlafapnoesyndrom. | |||

Veröffentlicht unter der Copyright-Lizenz.
"Attribution - Non-Commercial - NoDerivatives 4.0"
Keine kommerzielle Weiterverwendung ohne Genehmigung.
See: emh.ch/en/emh/rights-and-licences/