EMH Schweizerischer Ärzteverlag AG
Farnsburgerstrasse 8
CH-4132 Muttenz
+41 (0)61 467 85 44
support@swisshealthweb.ch
www.swisshealthweb.ch
Publié le 28.11.2018
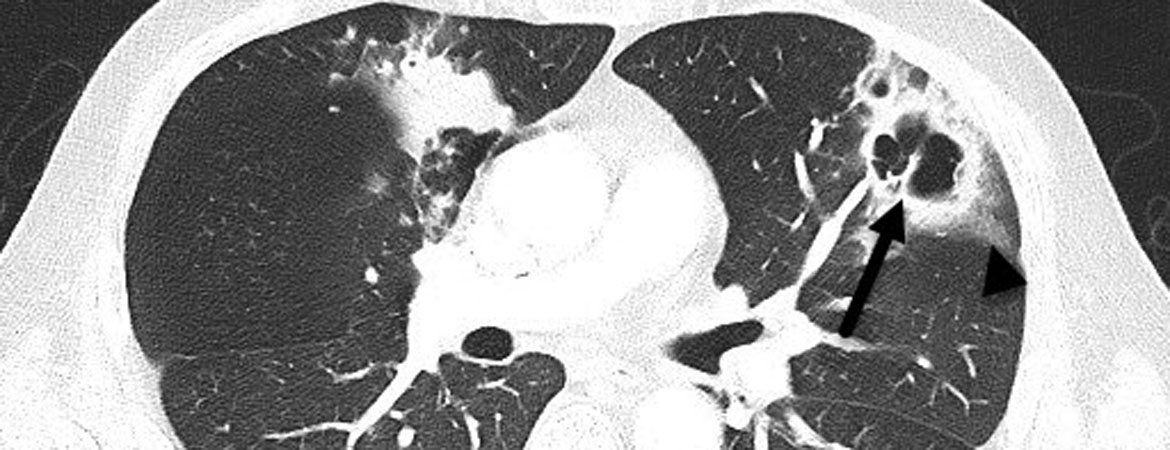
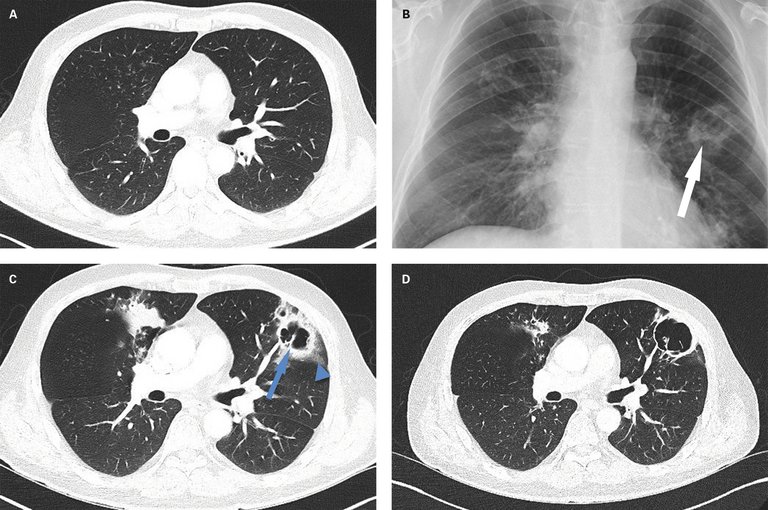
Die Zuweisung des 46-jährigen Patienten erfolgte aufgrund eines seit zwei Wochen progredienten, produktiven Hustens mit grün-gelblichem Auswurf, leichter Hämoptyse und angedeuteter Kavernenbildung im Thoraxröntgen.
Publié sous la licence du droit d'auteur.
"Attribution - Non-Commercial - NoDerivatives 4.0"
Pas de réutilisation commerciale sans autorisation..
See: emh.ch/en/emh/rights-and-licences/