EMH Schweizerischer Ärzteverlag AG
Farnsburgerstrasse 8
CH-4132 Muttenz
+41 (0)61 467 85 44
support@swisshealthweb.ch
www.swisshealthweb.ch
Publié le 22.05.2019
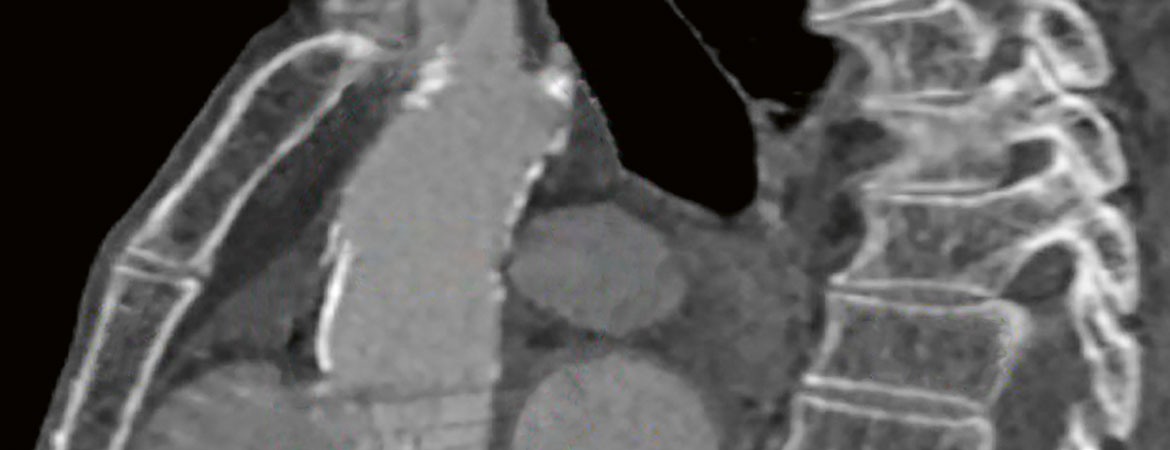
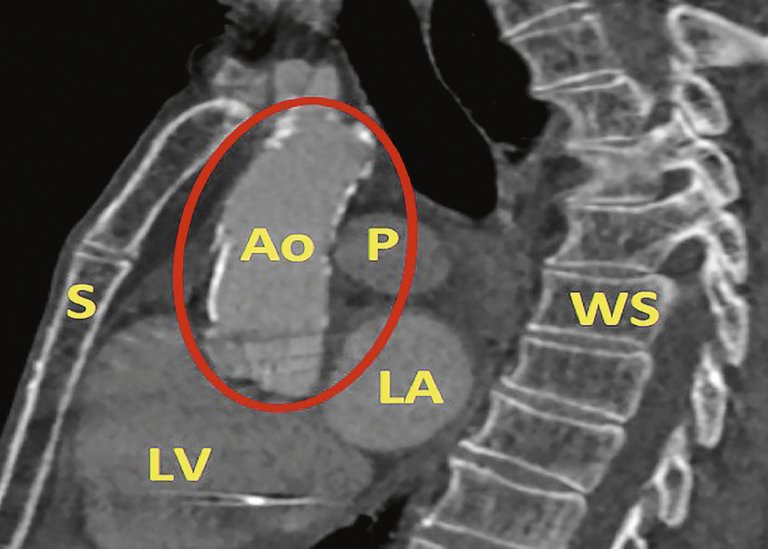
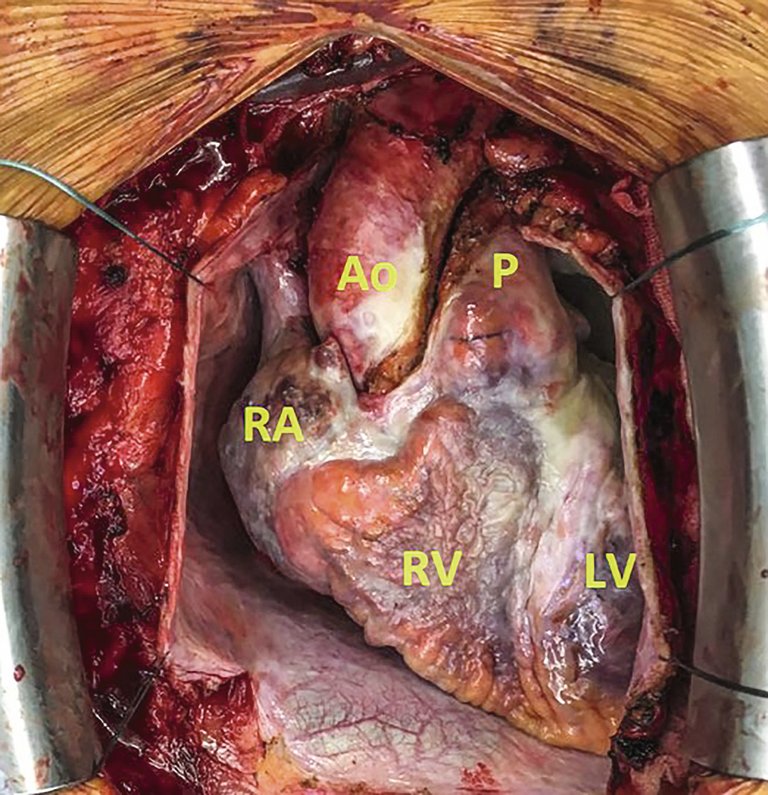
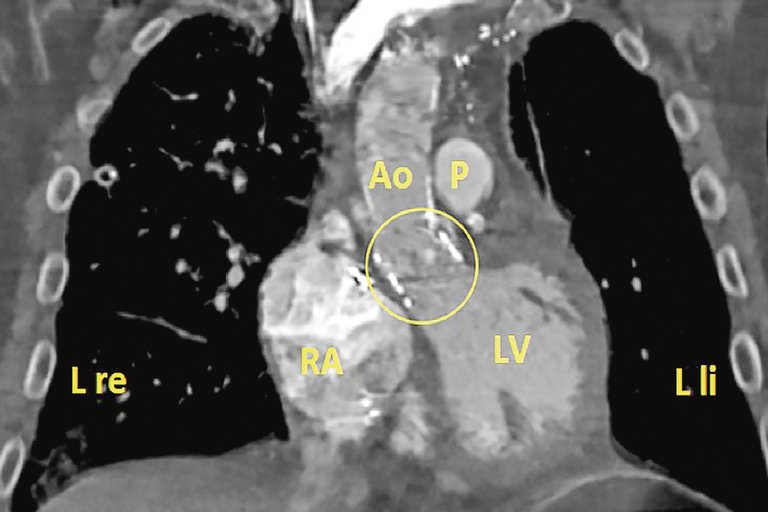
Les patients avec aorte de porcelaine doivent bénéficier d’une stratégie thérapeutique individuelle, qui devrait être déterminée par l’équipe cardiaque.
Publié sous la licence du droit d'auteur.
"Attribution - Non-Commercial - NoDerivatives 4.0"
Pas de réutilisation commerciale sans autorisation..
See: emh.ch/en/emh/rights-and-licences/