EMH Schweizerischer Ärzteverlag AG
Farnsburgerstrasse 8
CH-4132 Muttenz
+41 (0)61 467 85 44
support@swisshealthweb.ch
www.swisshealthweb.ch

Publié le 08.05.2019
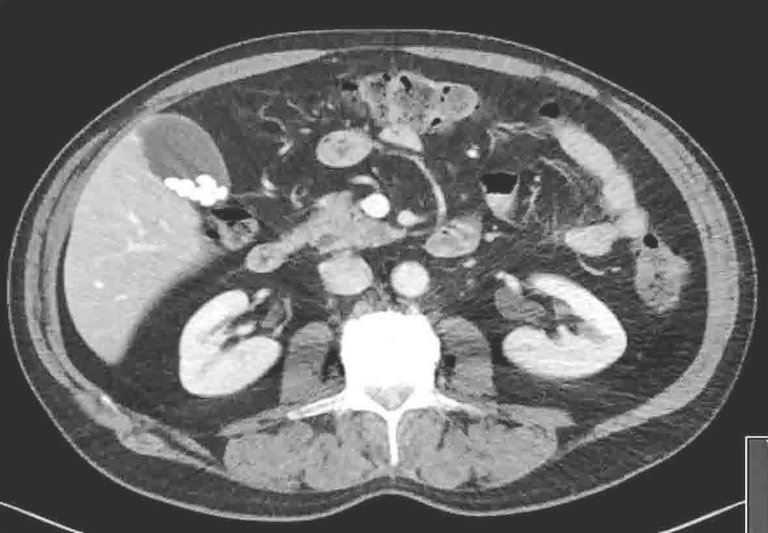
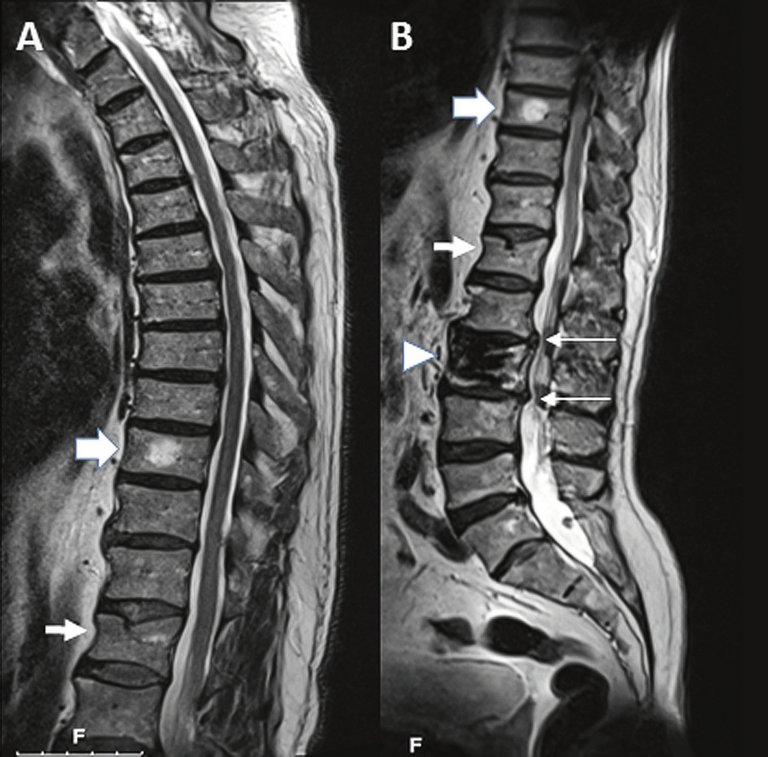
Lorsqu’un patient retraité souffre depuis 3 semaines de troubles du sommeil croissants et gênants en raison de maux de dos. Se lever et faire un tour pendant la nuit améliore les symptômes.


| Tableau 1: Neuroborréliose: probabilité diagnostique (selon les lignes directrices «neuroborréliose» de la «Deutsche Gesellschaft für Neurologie», société allemande de neurologie [1]). | |
| Neuroborréliose possible | Tableau clinique typique (atteintes des nerfs crâniens, méningite/ méningoradiculite, déficits neurologiques focaux) |
| Anticorps anti-IgG et/ou anti-IgM spécifiques de la borréliose dans le sérum | |
| Résultat de l’analyse du liquide céphalo-rachidien non disponible ou ponction de liquide céphalo-rachidien non réalisée | |
| Exclusion des autres causes possibles pour la symptomatique présente | |
| Neuroborréliose
probable En plus | Résultat de l’analyse du liquide céphalo-rachidien positif avec pléiocytose lymphocytaire, troubles de la barrière hémato-liquidienne et/ou synthèse intrathécale d’immunoglobulines. |
| Exclusion des autres causes possibles pour la symptomatique présente | |
| Neuroborréliose
certaine En plus | Synthèse intrathécale d’anticorps spécifiques à la borréliose (anticorps anti-IgG et/ou IgM positifs) dans le liquide céphalo-rachidien |
| Ou PCR positive / mise en évidence par culture dans le liquide céphalo-rachidien | |
| Exclusion des autres causes possibles pour la symptomatique présente | |
Publié sous la licence du droit d'auteur.
"Attribution - Non-Commercial - NoDerivatives 4.0"
Pas de réutilisation commerciale sans autorisation..
See: emh.ch/en/emh/rights-and-licences/