EMH Schweizerischer Ärzteverlag AG
Farnsburgerstrasse 8
CH-4132 Muttenz
+41 (0)61 467 85 44
support@swisshealthweb.ch
www.swisshealthweb.ch
Publié le 03.07.2019
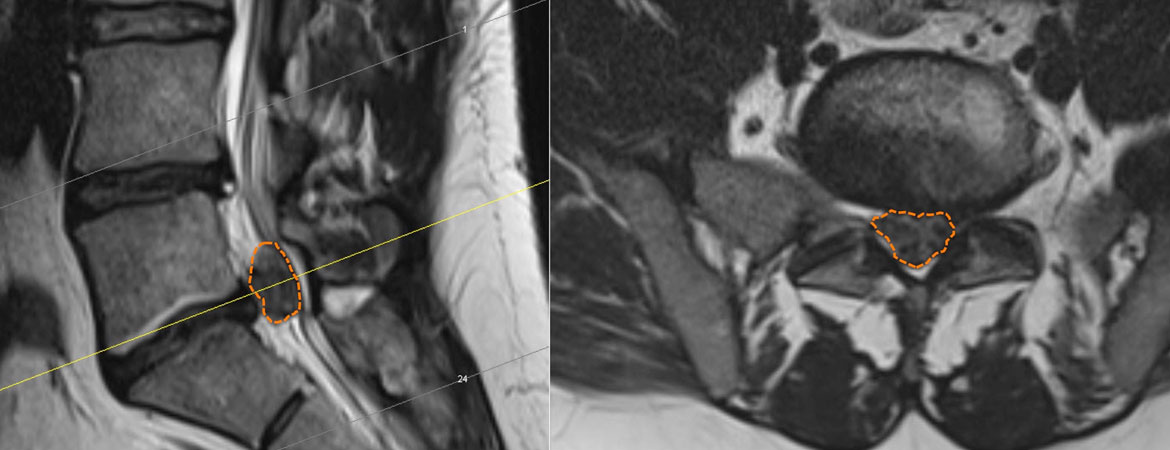
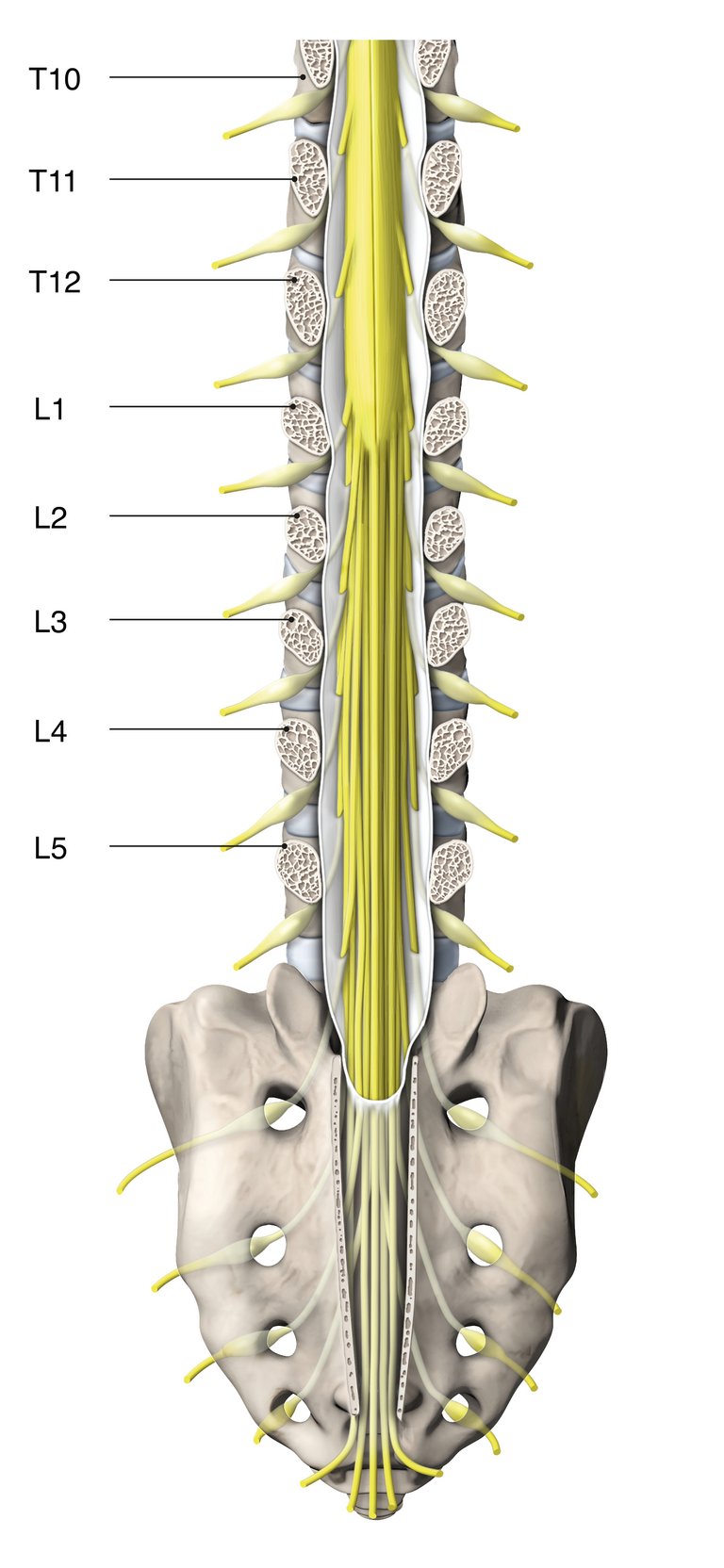
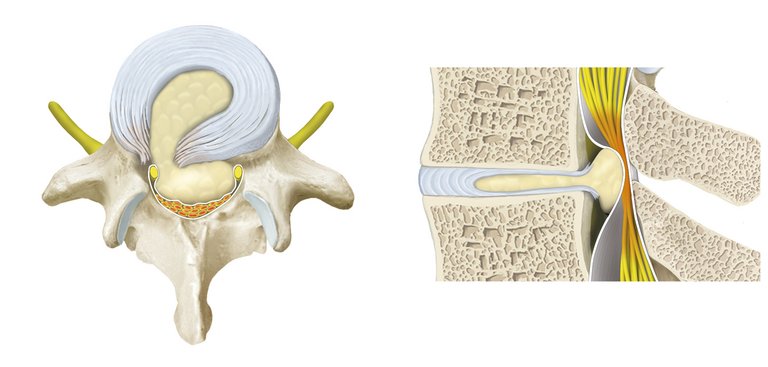
Le syndrome de la queue de cheval est une rareté absolue et c’est notamment la raison pour laquelle, dans la pratique, il confronte les cliniciens à un défi ne devant pas être sous-estimé.
| Tableau 1: Causes du syndrome de la queue de cheval. | |
| Dégénératives | Hernie discale |
| Sténose du canal rachidien | |
| Spondylolisthésis de haut grade | |
| Traumatiques | Fractures vertébrales |
| Hémorragies intrarachidiennes (péridurales, intradurales) | |
| Tumorales | Tumeurs rachidiennes primaires (extradurales, intradurales) |
| Métastases | |
| Infectieuses/inflammatoires | Empyème intrarachidien |
| Arachnoïdite | |
| Infection virale, avant tout chez les patients immunodéprimés | |
| Iatrogènes | Hémorragie péridurale ou intradurale post-opératoire/post-interventionnelle |
| Hémorragie spontanée sous anticoagulation | |
| Autres | Fractures vertébrales ostéoporotiques |
| Kystes rachidiens, avant tout kystes synoviaux | |
| Ischémie spinale | |
| Tableau 2: Symptômes classiques en cas de syndrome de la queue de cheval. | |
| 1 | Lombosciatique bilatérale |
| 2 | Anesthésie ou hypoesthésie périnéale/périanale (anesthésie en selle) |
| 3 | Trouble fonctionnel vésical: vessie neurogène (miction par regorgement, indolore) |
| 4 | Tonus du sphincter anal réduit ou aboli, parfois avec incontinence fécale |
| 5 | Dysfonction sexuelle (par ex. diminution de la sensibilité dans la région génitale, dysfonction érectile) |
| Tableau 3: «Red flags» publiés à l’échelle internationale pour le syndrome de la queue de cheval (modifié d’après [1]). |
| Dysfonction vésicale (aiguë) (rétention urinaire, miction par regorgement) |
| Douleurs irradiant dans les deux jambes |
| Troubles sensoriels diffus dans les membres inférieurs |
| Trouble de la marche |
| Lombosciatique |
| Parésie progressive dans les membres inférieurs |
| Tonus du sphincter anal réduit |
| Anesthésie en selle / anesthésie/hypoesthésie périnéale |
| Incontinence fécale |
| Tableau 4: Classification en stades du syndrome de la queue de cheval. | |
| CESS («Suspected») | Douleurs radiculaires bilatérales dans les jambes |
| CESI («Incomplete») | Troubles de la vidange vésicale, mais sans rétention urinaire |
| CESR («Retention») | Rétention urinaire indolore (vessie rétentionniste neurogène) |
| CESC («Complete») | Perte totale des fonctions de la queue de cheval |
Publié sous la licence du droit d'auteur.
"Attribution - Non-Commercial - NoDerivatives 4.0"
Pas de réutilisation commerciale sans autorisation..
See: emh.ch/en/emh/rights-and-licences/