EMH Schweizerischer Ärzteverlag AG
Farnsburgerstrasse 8
CH-4132 Muttenz
+41 (0)61 467 85 44
support@swisshealthweb.ch
www.swisshealthweb.ch
Publié le 07.12.2022
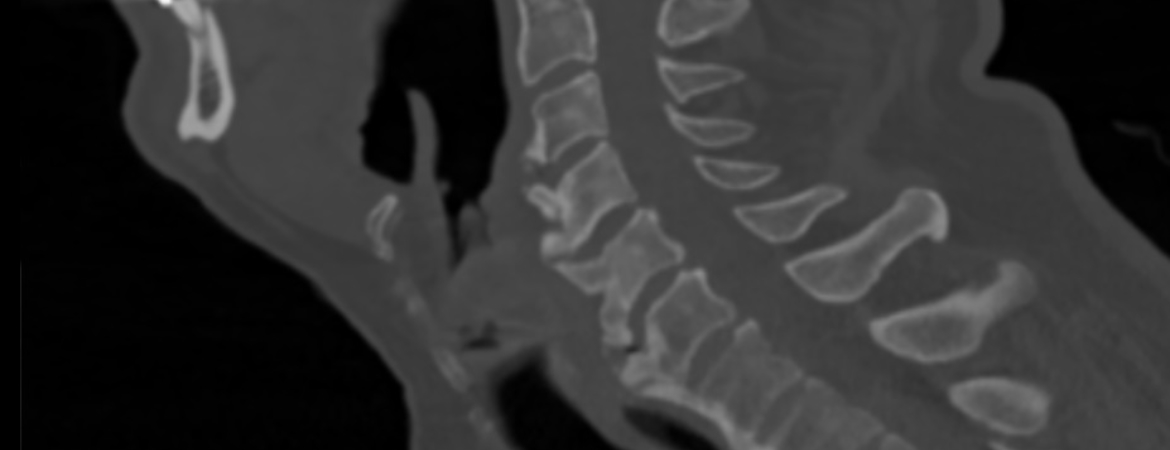
Un patient de 64 ans s’est présenté en urgence avec une dyspnée progressive, un enrouement, des maux de gorge et, depuis deux à trois mois, des difficultés marquées à déglutir.





Publié sous la licence du droit d'auteur.
"Attribution - Non-Commercial - NoDerivatives 4.0"
Pas de réutilisation commerciale sans autorisation..
See: emh.ch/en/emh/rights-and-licences/