EMH Schweizerischer Ärzteverlag AG
Farnsburgerstrasse 8
CH-4132 Muttenz
+41 (0)61 467 85 44
support@swisshealthweb.ch
www.swisshealthweb.ch

Publié le 11.02.2020
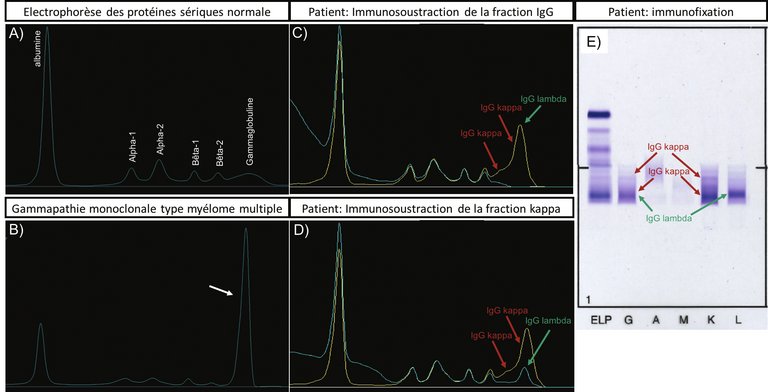
L`électrophorèse des protéines sériques, couplée à l`immunosoustraction, est l`examen de choix pour le diagnostic des paraprotéinémies.
| Tableau 1: Caractéristiques, composition et conditions physiologiques et pathologiques modifiant les différents pics observés sur une électrophorèse des protéines sériques (c.f. figure 1). | ||||||
| 1er pic: Albumine | 2ème pic: Protéines alpha-1 | 3ème pic: Protéines alpha-2 | 4ème pic: Protéines bêta-1 | 5ème pic: Protéines bêta-2 | 6ème pic: Protéines gamma | |
| Caractéristiques | Pic majeur (55–65%) Rare bisalbuminémie héréditaire ou acquise (bêta-lactames ou pancréatite chronique) | Pic mineur (1–4%) | Pic mineur (6–10%) | Pic mineur (4–7%) | Pic mineur (4–7%) | Pic intermédiaire (12–20%) |
| Protéines | Albumine | Alpha-1-antitrypsine, prothrombine, HDL, thyroglobuline | Antithrombine, haptoglobine, plasminogène, céruloplasmine, A2M | Transferrine, fibrinogène, hémopexine, LDL | Complément C3–C4, IgA | Immunoglobulines IgA, IgG, IgM, IgD, IgE; chaines légères kappa et lambda |
| Facteurs augmentant | Toujours fausse (hémoconcentration ou perfusion d’albumine) | Maladies inflammatoires aigües ou chroniques, syndrome néphrotique | Hémolyse intravasculaire (complexe hémoglobine- haptoglobine), syndrome néphrotique, maladie inflammatoire | Infection, inflammation, anémie ferriprive, paraprotéinémie dans la zone des bêta-globulines, grossesse, contraception hormonale | Hypercomplémentémie d’origine inflammatoire, cholestase intra- ou extrahépatique, gammapathie monoclonale à IgA, cirrhose éthylique/hépatite virale chronique (fusion des zones bêta-2 et gamma par augmentation des IgA polyclonales connue sous le terme de «bloc bêta-gamma») | c.f. tableau 2, anticorps monoclonaux |
| Facteurs diminuant | Dénutrition, néphropathies (syndrome néphrotique), hépatopathies (cirrhose, carcinome hépatocellulaire), pertes digestives (malabsorption) ou cutanées (brûlures étendues) | Hyperthyroïdie, hépatopathies, déficit congénital en alpha-1-antitrypsine, insuffisance hépatocellulaire, dénutrition | Insuffisance hépatocellulaire, dénutrition | Insuffisance hépatique, dénutrition, surcharge martiale, pertes digestives ou rénales | Hypocomplémentémie par consommation ou déficit congénital | Déficit immunitaire commun variable (CVID), immunodéficience primaire (PID), médicaments (immunosuppresseurs, AINS, phénytoïne, sulfasalazine ou D-pénicillamine) |
| Abréviations: AINS: anti-inflammatoire non stéroïdien; A2M: alpha-2 microglobuline; CVID: «common variable immune deficiency»; HDL: «high-density lipoprotein»; LDL: «low-density lipoprotein»; PID: «primary immuno-deficiency» | ||||||
| Tableau 2: Etiologies (par ordre croissant de prévalence de bas en haut) cancéreuses et non cancéreuses retrouvées le plus fréquemment lors d’électrophorèses des protéines sériques anormales. Les pathologies cancéreuses sont divisées selon les immunoglobulines produites, les pathologies non cancéreuses par catégories cliniques. | |||
| Type d’immunoglobuline | Immunoglobuline monoclonale (pathologies hémato-oncologiques) | Immunoglobuline polyclonale (pathologies non cancéreuses) | Catégories |
| IgG | – MGUS (très fréquent) – Myélome multiple (MM) (fréquent) – Plasmocytome – Syndrome de POEMS/Castelman (rare) | – Arthrite rhumatoïde – Lupus érythémateux systémique – Sclérodermie – Hypothyroïdie de Hashimoto | Auto-immune |
| IgM | – MM ou MGUS (très fréquent) – Macroglubulinémie de Waldenström (lymphome lymphoplasmocytaire) – Leucémie lymphoïde chronique (LLC) – Lymphome de bas grade – Plasmocytome | – HIV (lymphome, MM ou amyloidose sous HIV) – HBV/HCV (lymphome, MM ou amyloidose sous HBV/HCV) – Endocardite bactérienne – Mycobacterium tuberculosis – EBV | Infectieuse |
| IgA | – MM ou MGUS (très fréquent) – Plasmocytome – Syndrome de POEMS/Castelman (rare) | – Cirrhose (alcoolique, virale, toxique, NASH) – Hépatite – Syndrome de dépendance à l’alcool | Hépatique |
| Autres | – Pathologies lymphoprolifératives → LNH et LH – Maladie des chaînes lourdes (IgG, IgM, IgA, pas de dépôt amyloïde)(rare) | – Pyoderma gangrenosum – Xanthogranulomatose nécrobiotique | Cutanée |
| Chaînes légères | – Maladie des chaînes légères (en général kappa,
pas de dépôt amyloïde) – Amyloïdose primaire AL (en général lambda, dépôt amyloïde) | – Reconstitution immune après greffe de moelle autologue/allogreffe – CVID ou PID | Autres |
| Abréviations: CVID: «common variable immune deficiency»; EBV: Epstein-Barr virus; HIV: «human immunodeficiency virus»; HBV/HCV: hepatitis B/C virus; LH: lymphome de Hodgkin; LNH: lymphome non-Hodgkinien; MGUS: «monoclonal gammopathy of unknown significance»; MM: myélome multiple; PID: «primary immuno-deficiency»; POEMS: «polyneuropathy, organomegaly, endocrinopathy, monoclonal protein and skin changes»; PP: paraprotéinémie. | |||
Publié sous la licence du droit d'auteur.
"Attribution - Non-Commercial - NoDerivatives 4.0"
Pas de réutilisation commerciale sans autorisation..
See: emh.ch/en/emh/rights-and-licences/