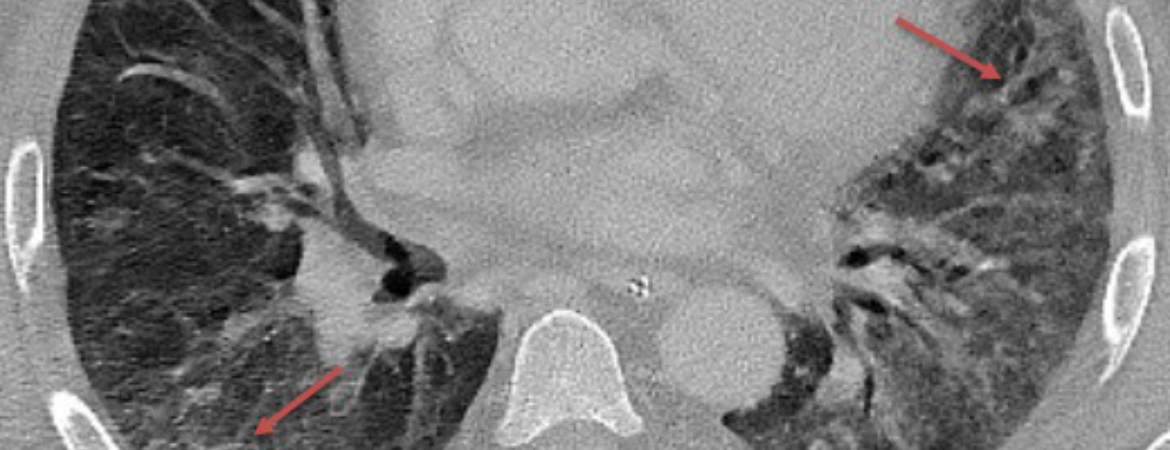
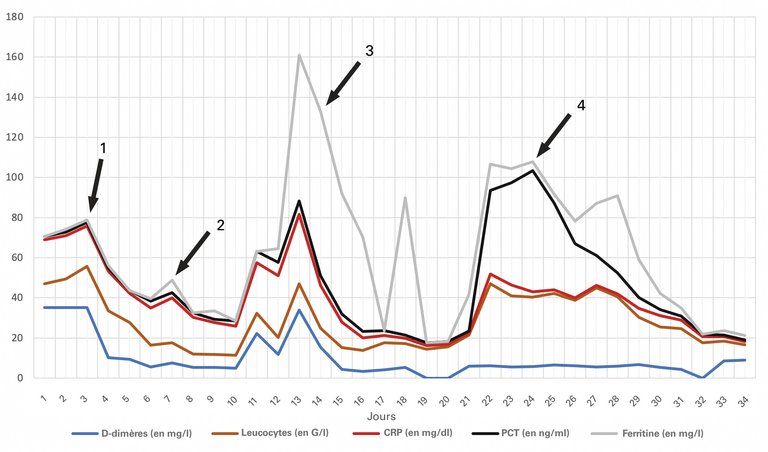
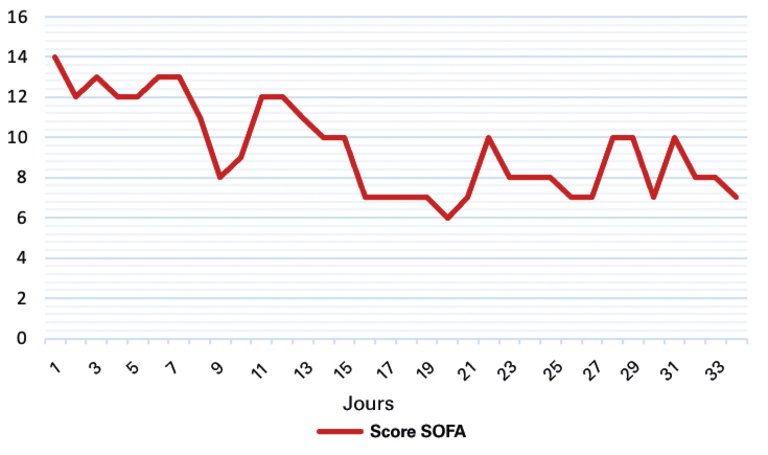
1 Feldt T, Karagiannidis C, Mager S, Mikolajewska A, Uhrig A, Witzke O, et al. Welche Rolle spielt ein mögliches Hyperinflammationssyndrom bei einer schweren COVID-19-Infektion und können hieraus Konsequenzen für die Therapie gezogen werden? 2020; doi.org/10.25646/7037.
2 Chalmers JD, Chotirmall SH. Rewiring the Immune Response in COVID-19. Am J Respir Crit Care Med. 2020;202(6):784–6. .
3 Wright DJM. Prevention of the cytokine storm in COVID-19. The Lancet Infectious Disease. 2021;21(1):25–6.
4 Siddiqi HK, Mehra MR. COVID-19 illness in native and immunosuppressed states: A clinical-therapeutic staging proposal. J Heart Lung Transplant. 2020;39(5):405–7.
5 Gäckler, Rohn, Witzke, Akutes Nierenversagen bei Covid-19, Der Nephrologe, 14.12.2020, Springer
6 Cheng Y, Luo R, Wang K, Zhang M, Wang Z, Dong L, et al. Kidney disease is associated with in hospital death of patients with COVID-19. Kidney Int. 2020;97(5):829–38.
7 Cheng Y, Luo R, Wang X, Wang K, Zhang N, Zhang M, et al. The incidence, risk factors, and prognosis of acute kidney injury in adult patients with coronavirus disease 2019. Clin J Am Soc Nephrol. 2020;15(10):1394–402.
8 Gross O, Moerer O, Weber M, Huber T, Scheithauer S. COVID-19-associated nephritis: early warning for disease severity and complications?, Lancet. 2020;395(e10236):e87–e88.
9 Pei G, Zhang Z, Peng J, Liu L, Zhang C, Yu C, et al. Renal involvement and early prognosis in patients with COVID-19 pneumonia. J Am Soc Nephrol. 2020;31(6):1157–65.
10 Möhnle P, Briegel J. Kortikosteroidgabe beim schweren akuten Lungenversagen : Sinnvolle Therapieoption? Anaesthesist. 2012;61(4):344–53.
11 Greenhalgh T, Knight M, A’Court C, Buxton M, Husain L. Management of post-acute covid-19 in primary care. BMJ. 2020;370:m3026.
12 Thomas L, Hintereder G. SARS-CoV-2. TD. 2021;19(1):14–6. doi: 10.47184/td.2021.01.02.
13 Moutchia J, Pokharel P, Kerri A, McGaw K, Uchai S, Nji M, et al. Clinical laboratory parameters associated with severe or critical novel coronavirus disease 2019 (COVID-19): A systematic review and meta-analysis. PLoS One. 2020;15(10):e0239802.
14 Faeq Husain-Syed, Horst-Walter Birk, Claudio Ronco. Coronavirus Disease 2019 and Acute Kidney Injury: What Have We Learned? Kidney Int Rep. 2021;6(4):872–74.
15 Rubin S, Orieux A, Prevel R, Garric A, Bats M, Dabernat S, et al. Characterization of acute kidney injury in critically ill patients with severe coronavirus disease 2019. Clin Kidney J. 2020;13(3):354–61.
16 Cheng Y, Luo R, Wang K, Zhang M, Wang Z, Dong L,et al. Kidney disease is associated with in hospital death of patients with COVID-19. Kidney Int. 2020;97(5):829–38.
17 Menter T, Haslbauer JD, Nienhold R, Savic S, Hopfer H, Deigendesch N, et al. Histopathology. 2020;77:198– 209.
18 Bellomo R, Kellum J, RoncoC, Wald R, Martensson J, Maiden Metal. Acute kidney injury in sepsis. Intensive Care Med. 2017;43(6):816–28.
19 Ronco C, Reis T, Husain-Syed F. Management of acute kidney injury in patients with COVID-19. Lancet Respir Med. 2020 8:738–42.
20 Risitano A, Mastellos D, Huber-Lang M, Yancopoulou D, Garlanda C, Ciceri F, et al. Complement as a target in COVID-19? Nat Rev Immunol. 2020;20(6):343–44.
21 Kudose S, Batal I, Santoriello D, Xu K, Barasch J, Peleg Y, Cet al. Kidney Biopsy Findings in Patients with COVID-19. J Am Soc Nephrol. 2020;31(9):1959–68.
22 Puelles VG, Lütgehetmann M, Lindenmeyer MT, Sperhake JP, Wong MN, Allweiss L, et al. Multiorgan and Renal Tropism of SARS-CoV-2. N Engl J Med. 2020;383:590–2.
23 Hoffmann M, Kleine-Weber H, Schroeder S, Krüger N, Herrler T, Erichsen S, et al. SARSCoV- 2 cell entry depends on ACE2 and TMPRSS2 and is blocked by clinically proven protease inhibitor.Cell. 2020;181(2):271–80.
23 Gupta A, Coca S, Chan L, Melamed M, Brenner S, Hayek S, et al. AKI treated with renal replacement therapy in critically ill patients with COVID-19. J Am Soc Nephrol. 2021;32(1):161–176.
24 Menter T, Haslbauer J, Nienhold R, Savic S, Hopfer H, Deigendesch N, et al. Postmortem examination of COVID-19 patients reveals diffuse alveolar damage with severe capillary congestion and veriegated findings in lungs and other organs suggesting vascular dysfunction. Histopathology. 2020;77(2):198–209.
25 Sparks M, South A, Welling P, Luther J, Cohen J, Byrd J, et al. Sound scinece before quick judgement regarding RAS blockade in COVID-19. Clin J Am Soc Nephrol. 2020;5(5):714–6.