EMH Schweizerischer Ärzteverlag AG
Farnsburgerstrasse 8
CH-4132 Muttenz
+41 (0)61 467 85 44
support@swisshealthweb.ch
www.swisshealthweb.ch

Publié le 24.03.2020
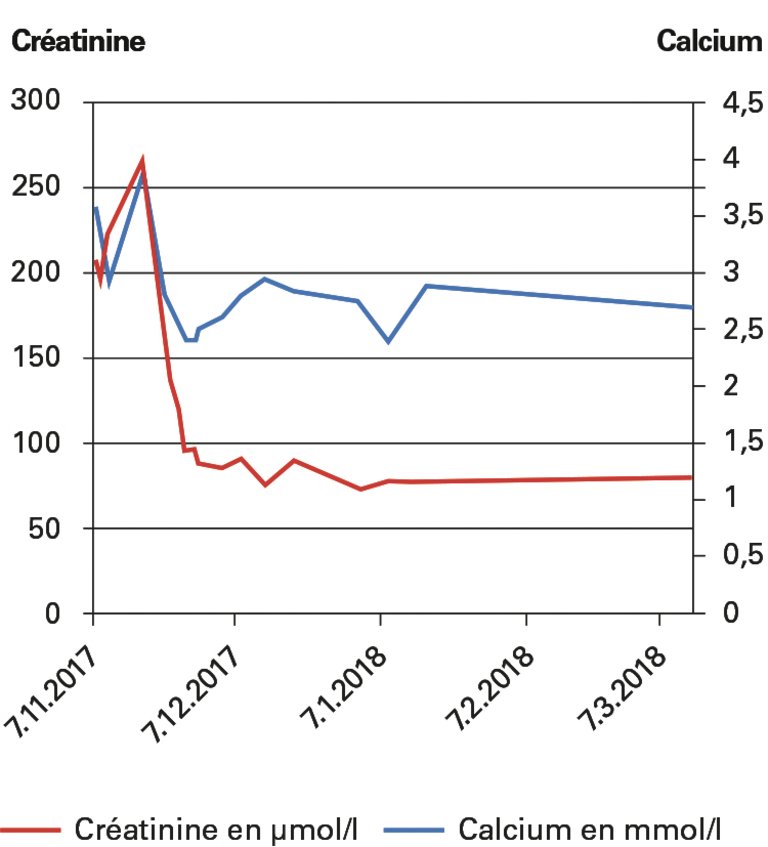
Un patient atteint de sclérose en plaques a été adressé à l’hôpital en raison d’une hypercalcémie symptomatique et d’une insuffisance rénale suite à la prise durant plusieurs mois de vitamine D à une dose de 100 000 UI/j.
| Tableau 1: Options thérapeutiques de l’hypercalcémie. | |||
| Début d’action | Mécanisme d’action | Limitations | |
| Solution isotonique de NaCl | Après quelques heures | Augmentation de l’excrétion de calcium par les reins via augmentation du débit tubulaire Correction de la déplétion volémique | Risque d’hypervolémie chez les patients avec insuffisance cardiaque et insuffisance rénale sévère |
| Diurétiques de l’anse | Après quelques heures | Inhibition de la réabsorption tubulaire de calcium par inhibition du canal NKCC2 dans l’anse de Henlé | Uniquement chez les patients avec hypervolémie sous administration d’une solution isotonique de NaCl Effets indésirables potentiels: trouble électrolytique, aggravation de la déshydratation |
| Bisphosphonates i.v. | Après 2–4 jours | Inhibition de la libération de calcium à partir des os Plus forte action hypocalcémiante que la solution isotonique de NaCl et la calcitonine | Contre-indication en cas d’insuffisance rénale avec débit de filtration glomérulaire estimé (DFGe) < 30 ml/min. Effets indésirables: insuffisance rénale aiguë, syndrome néphrotique et ostéonécroses de la mâchoire (cependant rares en cas d’administration à court terme) |
| Ligands RANK Dénosumab s.c. | Après 4–10 jours | Inhibition de la libération de calcium à partir des os | «Utilisation off-label». Utilisation en cas de DFGe < 30 ml/min. ou en cas d’hypercalcémie réfractaire sous bisphosphonates |
| Calcitonine i.m. | Après 4–6 heures | Inhibition de la libération de calcium à partir des os, augmentation de l’excrétion rénale de calcium | Tachyphylaxie, administration durant au maximum 48 heures |
| Glucocorticoïdes | Après 2–5 jours | Inhibition de l’activité de la 1α-hydroxylase, absorption réduite de calcium Bonne action avant tout en cas de maladies granulomateuses/lymphomes avec formation accrue de 1,25-(OH)-vitamine-D | Effets indésirables des corticostéroïdes |
| Calcimimétiques | Après 2–3 jours | Diminution de la parathormone (PTH) par sensibilité accrue au calcium du récepteur sensible au calcium de la parathyroïde | Autorisation uniquement en cas de carcinome parathyroïdien et d’hyperparathyroïdie secondaire dans le cadre d’une insuffisance rénale nécessitant une dialyse, sinon utilisation «off-label» |
| Hémodialyse Dialyse péritonéale | Après quelques heures La dialyse péritonéale prend un peu plus de temps | Elimination extracorporelle du calcium | Uniquement en cas d’insuffisance rénale ou d’insuffisance cardiaque très sévère, lorsqu’il est impossible d’administrer suffisamment de liquide, ou en cas d’hypercalcémie symptomatique très sévère ne répondant pas à d’autres mesures Effet indésirable: complications associées au cathéter |
Publié sous la licence du droit d'auteur.
"Attribution - Non-Commercial - NoDerivatives 4.0"
Pas de réutilisation commerciale sans autorisation..
See: emh.ch/en/emh/rights-and-licences/