1 Lucca I, Klatte T, Fajkovic H, de Martino M, Shariat SF. Gender differences in incidence and outcomes of urothelial and kidney cancer. Nat Rev Urol. 2015;12(12):653.
2 Rouprêt M, Malavaud B, Molinier L, Leleu H, Blachier M, Marteau F. Cost-effectiveness of transurethral resection of the bladder with blue light in patients with non muscle invasive bladder cancer in France. Prog En Urol J Assoc Fr Urol Société Fr Urol. 2015;25(5):256–64.
4 Dietrich K, Demidenko E, Schned A, Zens MS, Heaney J, Karagas MR. Parity, early menopause and the incidence of bladder cancer in women: a case-control study and meta-analysis. Eur J Cancer Oxf Engl. 1990. 2011;47(4):592–9.
5 Emil A, Tanagho, McAninch JW. Smith’s General Urology, 17th Editon (Lange Clinical Medicine).
6 Raman JD, Messer J, Sielatycki JA, Hollenbeak CS. Incidence and survival of patients with carcinoma of the ureter and renal pelvis in the USA, 1973–2005. BJU Int. 2011;107(7):1059–64.
7 Cosentino M, Palou J, Gaya JM, Breda A, Rodriguez-Faba O, Villavicencio-Mavrich H. Upper urinary tract urothelial cell carcinoma: location as a predictive factor for concomitant bladder carcinoma. World J Urol. 2013;31(1):141–5.
8 Bruyninckx R, Buntinx F, Aertgeerts B, Van Casteren V. The diagnostic value of macroscopic haematuria for the diagnosis of urological cancer in general practice. Br J Gen Pract J R Coll Gen Pract. 2003;53(486):31–5.
9 Rink M, Xylinas E, Babjuk M, Hansen J, Pycha A, Comploj E, et al. Impact of smoking on outcomes of patients with a history of recurrent nonmuscle invasive bladder cancer. J Urol. 2012;188(6):2120–7.
10 Rink M, Zabor EC, Furberg H, Xylinas E, Ehdaie B, Novara G, et al. Impact of smoking and smoking cessation on outcomes in bladder cancer patients treated with radical cystectomy. Eur Urol. 2013;64(3):456–64.
11 Fidler MM, Soerjomataram I, Bray F. A global view on cancer incidence and national levels of the human development index. Int J Cancer. 2016;139(11):2436–46.
12 Davidson MB. Pioglitazone (Actos) and bladder cancer: Legal system triumphs over the evidence. J Diabetes Complications. 2016;30(6):981–5.
13 Netto GJ. Molecular biomarkers in urothelial carcinoma of the bladder: are we there yet? Nat Rev Urol. 2012;9(1):41–51.
14 Astrid Lièvre (1), Pierre Laurent-Puig. La voie de signalisation RAS/MAPK RAS/MAPK signaling pathway. Cancéro dig. Vol. 2 N° 1 – 2010 – 38–42 DOI 10.4267/2042/30747.
15 Professionals S-O. Non-muscle-invasive Bladder Cancer [Internet]. Uroweb. 2015 [cited 2016 Aug 26]. Available from:
https://uroweb.org/guideline/non-muscle-invasive-bladder-cancer/#3
16 Witjes JA, Compérat E, Cowan NC, De Santis M, Gakis G, Lebret T, et al. EAU Guidelines on Muscle-invasive and Metastatic Bladder Cancer: Summary of the 2013 Guidelines. Eur Urol. 2014;65(4):778–92.
17 Palou J, Rodríguez-Rubio F, Huguet J, Segarra J, Ribal MJ, Alcaraz A, et al. Multivariate analysis of clinical parameters of synchronous primary superficial bladder cancer and upper urinary tract tumor. J Urol. 2005;174(3):859–61; discussion 861.
18 Ito Y, Kikuchi E, Tanaka N, Miyajima A, Mikami S, Jinzaki M, et al. Preoperative hydronephrosis grade independently predicts worse pathological outcomes in patients undergoing nephroureterectomy for upper tract urothelial carcinoma. J Urol. 2011;185(5):1621–6.
19 Rouprêt M, Babjuk M, Compérat E, Zigeuner R, Sylvester R, Burger M, et al. European guidelines on upper tract urothelial carcinomas: 2013 update. Eur Urol. 2013;63(6):1059–71.
20 Lebret T, Méjean A. [Metastases from urethelial carcinoma: role of chemotherapy]. Prog En Urol J Assoc Fr Urol Société Fr Urol. 2008;18 Suppl 7:261–76.
21 Lebret T, Méjean A. [Rare locations of metastases from urothelial carcinoma]. Prog En Urol J Assoc Fr Urol Société Fr Urol. 2008;18 Suppl 7:289–97.
22 Hautmann RE, Gschwend JE, de Petriconi RC, Kron M, Volkmer BG. Cystectomy for transitional cell carcinoma of the bladder: results of a surgery only series in the neobladder era. J Urol. 2006;176(2):486–92; discussion 491–2.
23 Madersbacher S, Hochreiter W, Burkhard F, Thalmann GN, Danuser H, Markwalder R, et al. Radical cystectomy for bladder cancer today – a homogeneous series without neoadjuvant therapy. J Clin Oncol Off J Am Soc Clin Oncol. 2003;21(4):690–6.
24 Stein JP, Lieskovsky G, Cote R, Groshen S, Feng AC, Boyd S, et al. Radical cystectomy in the treatment of invasive bladder cancer: long-term results in 1,054 patients. J Clin Oncol Off J Am Soc Clin Oncol. 2001;19(3):666–75.
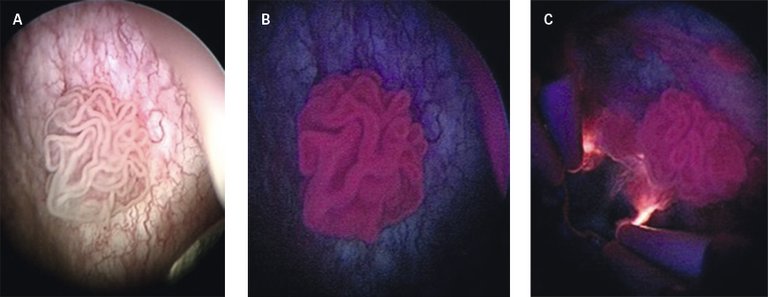
25 Burger M, Grossman HB, Droller M, Schmidbauer J, Hermann G, Drăgoescu O, et al. Photodynamic diagnosis of non-muscle-invasive bladder cancer with hexaminolevulinate cystoscopy: a meta-analysis of detection and recurrence based on raw data. Eur Urol. 2013;64(5):846–54.
26 Hurle R, Lazzeri M, Colombo P, Buffi N, Morenghi E, Peschechera R, et al. “En Bloc” Resection of Nonmuscle Invasive Bladder Cancer: A Prospective Single-center Study. Urology. 2016;90:126–30.
27 Kang M, Jeong CW, Kwak C, Kim HH, Ku JH. Single, immediate postoperative instillation of chemotherapy in non-muscle invasive bladder cancer: a systematic review and network meta-analysis of randomized clinical trials using different drugs. Oncotarget. 2016 Jun 14.
28 Leissner J, Ghoneim MA, Abol-Enein H, Thüroff JW, Franzaring L, Fisch M, et al. Extended radical lymphadenectomy in patients with urothelial bladder cancer: results of a prospective multicenter study. J Urol. 2004;171(1):139–44.
29 Dhar NB, Klein EA, Reuther AM, Thalmann GN, Madersbacher S, Studer UE. Outcome after radical cystectomy with limited or extended pelvic lymph node dissection. J Urol. 2008;179(3):873–8; discussion 878.
30 Gakis G, Efstathiou J, Lerner SP, Cookson MS, Keegan KA, Guru KA, et al. ICUD-EAU International Consultation on Bladder Cancer 2012: Radical cystectomy and bladder preservation for muscle-invasive urothelial carcinoma of the bladder. Eur Urol. 2013;63(1):45–57.
31 Pectasides D, Pectasides M, Nikolaou M. Adjuvant and neoadjuvant chemotherapy in muscle invasive bladder cancer: literature review. Eur Urol. 2005;48(1):60–7; discussion 67–8.
32 Droller MJ. Neoadjuvant cisplatin, methotrexate, and vinblastine chemotherapy for muscle-invasive bladder cancer: a randomised controlled trial. J Urol. 2000;163(5):1602–3.
33 Leow JJ, Martin-Doyle W, Rajagopal PS, Patel CG, Anderson EM, Rothman AT, et al. Adjuvant chemotherapy for invasive bladder cancer: a 2013 updated systematic review and meta-analysis of randomized trials. Eur Urol. 2014;66(1):42–54.
34 Takata R, Katagiri T, Kanehira M, Tsunoda T, Shuin T, Miki T, et al. Predicting response to methotrexate, vinblastine, doxorubicin, and cisplatin neoadjuvant chemotherapy for bladder cancers through genome-wide gene expression profiling. Clin Cancer Res Off J Am Assoc Cancer Res. 2005;11(7):2625–36.
35 Takata R, Katagiri T, Kanehira M, Shuin T, Miki T, Namiki M, et al. Validation study of the prediction system for clinical response of M-VAC neoadjuvant chemotherapy. Cancer Sci. 2007;98(1):113–7.
36 Scolieri MJ, Paik ML, Brown SL, Resnick MI. Limitations of computed tomography in the preoperative staging of upper tract urothelial carcinoma. Urology. 2000;56(6):930–4.
37 Colin P, Neuzillet Y, Pignot G, Rouprêt M, Comperat E, Larré S, et al. [Follow-up of urothelial carcinoma: Review of the Cancer Committee of the French Association of Urology]. Prog En Urol J Assoc Fr Urol Société Fr Urol. 2015;25(10):616–24.
38 Brown GA, Matin SF, Busby JE, Dinney CPN, Grossman HB, Pettaway CA, et al. Ability of clinical grade to predict final pathologic stage in upper urinary tract transitional cell carcinoma: implications for therapy. Urology. 2007;70(2):252–6.
39 Wang JK, Tollefson MK, Krambeck AE, Trost LW, Thompson RH. High rate of pathologic upgrading at nephroureterectomy for upper tract urothelial carcinoma. Urology. 2012;79(3):615–9.
40 Botteman MF, Pashos CL, Redaelli A, Laskin B, Hauser R. The health economics of bladder cancer: a comprehensive review of the published literature. PharmacoEconomics. 2003;21(18):1315–30.